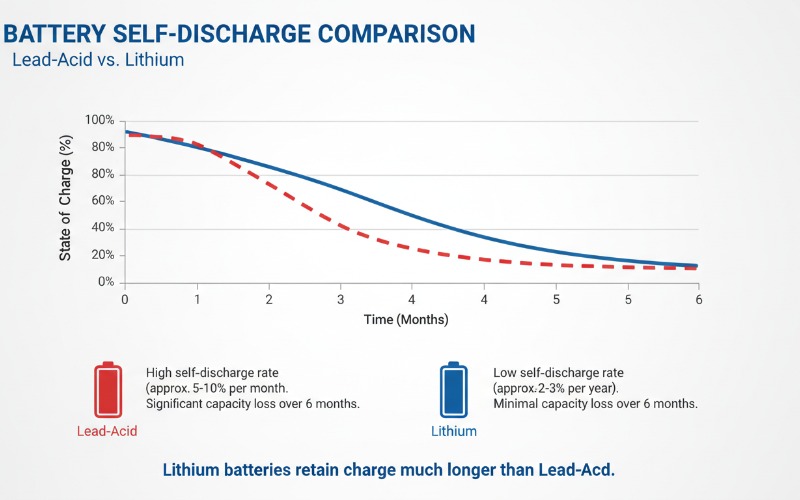
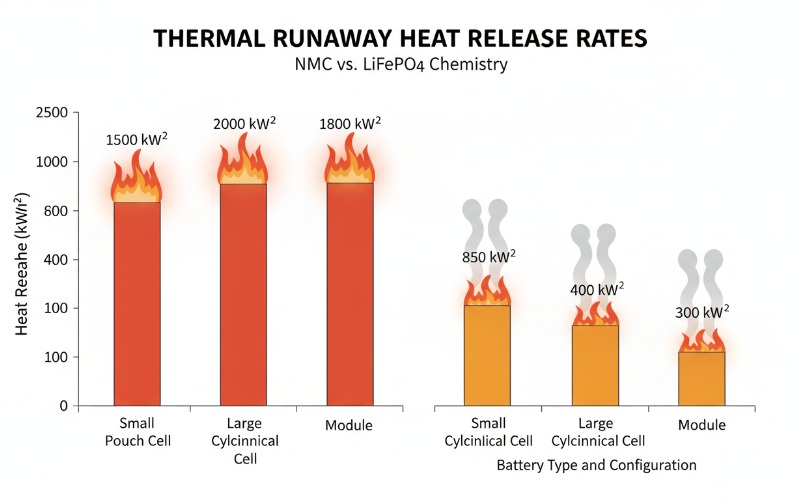
Einführung
Blei-Säure-Batterien gehören zu den am häufigsten in verschiedenen Anwendungen verwendeten Batterietypen. Das Verständnis des Grundprinzips von Blei-Säure-Batterien ist notwendig, um sie in verschiedenen Anwendungen sinnvoll nutzen zu können, beispielsweise in der Automobilindustrie oder in unterbrechungsfreien Stromquellen. Die Verbesserung der Vertrautheit mit diesen Konzepten kann die Fähigkeit verbessern, sie ordnungsgemäß einzuhalten und gleichzeitig ihr Potenzial für eine optimale Leistung bei Bedarf in verschiedenen Umgebungen/Kontexten zu maximieren. In diesem Artikel werden die chemischen Reaktionen im Ionenflussmechanismus untersucht, die zur Steuerung der Lade- und Entladevorgänge erforderlich sind.
Chemische Reaktion der positiven und negativen Elektroden
Beim Betrieb der Blei-Säure-Batterien kommt es zu chemischen Reaktionen an ihren beiden Primärelektroden – der positiven Elektrode, bestehend aus Bleidioxid, und der negativen Elektrode, bestehend aus reinem Blei. Das Verständnis der Funktionsweise der Batterie beginnt mit ihrem Design und ihrer Konstruktion.
Wenn Schwefelsäure zusammen mit einer anderen Verbindung namens „Bleidioxid“ an der positiven Elektrode ausgesetzt wird, führt dieses Verfahren zur Produktion von „Sauerstoffionen“ sowie zu einer Verschmelzung namens „Bleisulfat“. Im gleichen Tempo verbindet sich reines Blei mit Schwefelsäure zu Wasserstoffionen und ergibt Bleisulfat. Durch die zuvor beschriebene Abfolge von Ereignissen wird chemische Energie in elektrische Energie umgewandelt, die in der modernen Gesellschaft für verschiedene Zwecke genutzt wird.
Der Ionenfluss in einer Elektrolytlösung
Um einen effektiven Ionenaustausch zwischen positiv und negativ markierten Elektroden zu ermöglichen, ist die Einführung einer Elektrolytlösung von grundlegender Bedeutung. Diese Lösung besteht häufig aus mit Schwefelsäure vermischtem Wasser, das als Träger für diese Ionen fungiert. Diese wichtige Verbindung kann durch ihre Sulfat-Ionen (SO₄²⁻), die bei jedem Lade- und Entladevorgang aktiv wandern, die ordnungsgemäße Batteriefunktion unterstützen.
Im Lademodus erleichtert elektrischer Strom die Bewegung geladener Schwefelverbindungen, die in Elektrolyten in einer typischen Batterie gelöst sind, über positiv geladene Leiterbahnen hinweg und gelangt durch elektrolytische Wirkung zu negativ geladenen Bereichen oder Leiterbahnen. Diese Transformationsaktivität kehrt die Umwandlungsbildung um, die die vorherige Speicherung behinderte, indem sie durch den Lade-Entlade-Zyklus feste in flüssige Zustände umwandelt. Durch die schrittweise Wiederherstellung werden diese Batterien daher in der Lage, elektrische Ladungen sicher zu speichern und unterschiedliche Speicherkapazitäten für verschiedene Anwendungen zu bieten.
Schema und Beschreibung des Lade- und Entladevorgangs
Es mag kompliziert erscheinen, genau zu verstehen, wie wiederaufladbare Batterien, beispielsweise solche mit Blei-Säure-Aufladung, funktionieren, können aber einfacher zu handhaben sein, wenn sie mithilfe von Schaltplanbeschreibungen visualisiert werden. Im Wesentlichen beobachten wir, dass das Laden eine externe Stromversorgung erfordert, damit eine interne chemische Reaktion stattfinden kann, bei der sich inaktive Bereiche wie Bleisulfat wieder in aktive Chemikalien wie reines Blei oder Bleidioxid umwandeln – was eine erneute Energiespeicherung in diesen Zellen unserer wiederaufladbaren Batterien ermöglicht.
Beim Entladen elektrischer Energie in einen externen Stromkreis durchläuft eine Batterie eine chemische Umwandlung: Ihre Schwefelsäure reagiert mit reinem Blei und Bleidioxid, wodurch große Mengen Bleisulfat entstehen. Dieser Vorgang verbraucht kontinuierlich die gespeicherte Energie des Geräts, bis seine Spannung vollständig abnimmt und ein sofortiges Aufladen für eine regelmäßige weitere Verwendung erforderlich ist.
Das Fazit
Kurz gesagt: Kenntnisse über die Funktionsweise von Blei-Säure-Batterien sind für die Maximierung ihrer Produktivität und Langlebigkeit von grundlegender Bedeutung. Der Schlüsselfaktor für seine Gesamtfunktionalität ist die Vielzahl chemischer Reaktionen, die an beiden Polen in Verbindung mit dem Ionenfluss durch die Elektrolytlösung während der Lade-Entlade-Zyklen ablaufen.









 en
en  ara
ara  de
de  fra
fra  kor
kor  ru
ru  spa
spa  vie
vie