مقدمة
تعد بطاريات الرصاص الحمضية من أكثر أنواع البطاريات شيوعًا المستخدمة في التطبيقات المختلفة. يعد فهم المبدأ الأساسي لبطاريات الرصاص الحمضية أمرًا ضروريًا للاستفادة منها بشكل جيد في تطبيقات مختلفة ، مثل مصادر الطاقة غير المنقطعة في السيارات. إن زيادة الإلمام بهذه المفاهيم يمكن أن يعزز قدرة الفرد على الحفاظ عليها بشكل صحيح مع تعظيم إمكاناتها لتحقيق الأداء الأمثل عند الطلب عبر الإعدادات / السياقات المختلفة. تستكشف هذه المقالة التفاعلات الكيميائية في آلية تدفق الأيونات اللازمة للتحكم في عمليات الشحن والتفريغ.
التفاعل الكيميائي للأقطاب الموجبة والسالبة
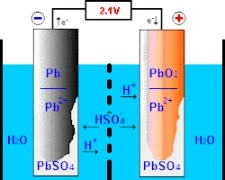
تستلزم عملية بطاريات الرصاص الحمضية تفاعلات كيميائية عند قطبيها الأساسيين – القطب الموجب ، المكون من ثاني أكسيد الرصاص ، والقطب السالب ، الرصاص النقي. يبدأ فهم عمل البطارية بتصميمها وبنيتها.
عند التعرض لحمض الكبريتيك مع مركب آخر يسمى “ثاني أكسيد الرصاص” عند القطب الموجب ، ينتج عن هذا الإجراء إنتاج “أيونات الأكسجين” بالإضافة إلى اندماج يسمى “كبريتات الرصاص”. بوتيرة متساوية ، يتحد الرصاص النقي مع حمض الكبريتيك لتكوين أيونات الهيدروجين وينتج كبريتات الرصاص. نتيجة لسلسلة الأحداث الموصوفة سابقًا ، يتم تحويل الطاقة الكيميائية إلى طاقة كهربائية ، والتي تستخدم لأغراض مختلفة في المجتمع الحديث.
تدفق الأيونات في محلول إلكتروليت
من الضروري تقديم محلول إلكتروليت لتمكين التبادل الأيوني الفعال بين الأقطاب الكهربائية ذات العلامات الإيجابية والسلبية. يشتمل هذا المحلول بشكل متكرر على ماء ممزوج بحمض الكبريتيك الذي يعمل كحامل لهذه الأيونات. يمكن لهذا المركب المهم أن يدعم وظيفة البطارية المناسبة من خلال أيونات الكبريتات (SO₄²⁻) ، والتي تنتقل بنشاط خلال كل شحنة وتفريغ.
أثناء وجوده في وضع الشحن ، يسهل التيار الكهربائي حركات حركة مركبات الكبريت المشحونة التي تذوب في إلكتروليتات داخل بطارية نموذجية عبر آثار موجبة الشحنة ، والانتقال إلى مناطق أو آثار سالبة الشحنة باستخدام إجراء التحليل الكهربائي. يعكس هذا النشاط التحويلي تشكيل التحويل الذي أعاق التخزين السابق عن طريق تحويل الحالات الصلبة إلى الحالة السائلة من خلال دورة الشحن والتفريغ . وبالتالي ، فإن الاستعادة التدريجية تمكن هذه البطاريات من أن تصبح قادرة بدرجة كافية على تخزين الشحنات الكهربائية بأمان مع إمكانيات تخزين متنوعة عبر تطبيقات مختلفة.
رسم تخطيطي ووصف لعملية الشحن والتفريغ
الفهم الدقيق للكيفية التي قد تبدو بها البطاريات القابلة لإعادة الشحن ، مثل تلك التي تستخدم إعادة شحن تصميم حمض الرصاص ، معقدة ولكن يمكن إدارتها بشكل أكبر عند تصورها باستخدام أوصاف المخططات. في الأساس ، نلاحظ أن الشحن يتطلب الطاقة من مصدر كهربائي خارجي بحيث يمكن أن يحدث تفاعل كيميائي داخلي حيث تعيد المناطق غير النشطة مثل كبريتات الرصاص ترتيب نفسها إلى مواد كيميائية نشطة مرة أخرى ، مثل الرصاص النقي أو ثاني أكسيد الرصاص – مما يسمح بتخزين الطاقة المتجددة في تلك الخلايا من بطارياتنا القابلة لإعادة الشحن.
أثناء تفريغ الطاقة الكهربائية في دائرة خارجية ، تخضع البطارية لعملية تحول كيميائي: يتفاعل حمض الكبريتيك مع الرصاص النقي وثاني أكسيد الرصاص لإنتاج كميات وفيرة من كبريتات الرصاص. تستهلك هذه العملية الطاقة المخزنة للجهاز بشكل ثابت حتى ينخفض جهده تمامًا ، مما يتطلب إعادة الشحن الفوري لمزيد من الاستخدام بانتظام.
الخط السفلي
باختصار ، تعد المعرفة حول كيفية عمل بطاريات الرصاص الحمضية أمرًا أساسيًا لزيادة إنتاجيتها وطول عمرها. العامل الرئيسي الذي يساهم في وظيفتها العامة هو تعدد التفاعلات الكيميائية التي تحدث في كلا القطبين بالتزامن مع تدفق الأيونات عبر محلولها الإلكتروليتي أثناء دورات الشحن والتفريغ.