Вступ
Свинцево-кислотні акумулятори – один з найпоширеніших типів батарей, що використовуються в різних сферах. Розуміння основного принципу роботи свинцево-кислотних акумуляторів необхідне для ефективного використання їх у різних сферах застосування, наприклад, в автомобілях або джерелах безперебійного живлення. Ознайомлення з цими концепціями може покращити здатність підтримувати їх належним чином, одночасно максимізуючи їхній потенціал для оптимальної роботи на вимогу в різних умовах/контекстах. У цій статті досліджуються хімічні реакції в механізмі іонного потоку, необхідні для управління процесами заряджання і розряджання.
Хімічна реакція позитивного та негативного електродів
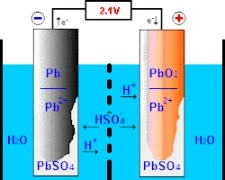
У процесі роботи свинцево-кислотних акумуляторів відбуваються хімічні реакції на двох первинних електродах – позитивному, що складається з діоксиду свинцю, і негативному, що складається з чистого свинцю. Розуміння роботи акумулятора починається з його дизайну та конструкції.
Під впливом сірчаної кислоти разом з іншою сполукою під назвою “діоксид свинцю” на позитивному електроді ця процедура призводить до утворення “іонів кисню”, а також амальгами під назвою “сульфат свинцю”. З такою ж швидкістю чистий свинець з’єднується з сірчаною кислотою, утворюючи іони водню, і утворює сульфат свинцю. В результаті раніше описаної серії подій хімічна енергія перетворюється на електричну, яка використовується для різних цілей у сучасному суспільстві.
Потік іонів у розчині електроліту
Дуже важливо ввести розчин електроліту, щоб забезпечити ефективний іонний обмін між позитивно і негативно маркованими електродами. Цей розчин часто складається з води, змішаної з сірчаною кислотою, яка виступає носієм цих іонів. Ця важлива сполука підтримує належне функціонування акумулятора завдяки сульфат-іонам (SO₄²-), які активно мігрують під час кожного заряду та розряду.
У режимі зарядки електричний струм сприяє переміщенню заряджених сполук сірки, які розчинені в електролітах у типовому акумуляторі, по позитивно заряджених слідах, переходячи до негативно заряджених ділянок або слідів за допомогою електролітичної дії. Ця трансформаційна активність обертає конверсійне утворення, яке перешкоджало попередньому зберіганню, шляхом перетворення твердого стану в рідкий через цикл заряджання-розряджання. Таким чином, поступове відновлення дозволяє цим батареям стати достатньо придатними для надійного зберігання електричних зарядів з різноманітними можливостями зберігання в різних сферах застосування.
Схема та опис процесу заряджання та розряджання
Розуміння того, як саме перезаряджаються акумуляторні батареї, наприклад, ті, що використовують свинцево-кислотну конструкцію, може здатися складним, але може бути більш зрозумілим, якщо візуалізувати його за допомогою схемних описів. По суті, ми бачимо, що зарядка вимагає живлення від зовнішнього джерела електроенергії, щоб відбулася внутрішня хімічна реакція, в результаті якої неактивні ділянки, такі як сульфат свинцю, знову перетворюються на активні хімічні речовини, такі як чистий свинець або діоксид свинцю, що дозволяє відновити накопичення енергії в комірках наших акумуляторних батарей.
Віддаючи електричну енергію в зовнішній ланцюг, акумулятор зазнає хімічних перетворень: його сірчана кислота реагує з чистим свинцем і діоксидом свинцю, утворюючи велику кількість сульфату свинцю. Цей процес постійно споживає накопичену енергію пристрою, поки його напруга повністю не знизиться, що вимагає негайної підзарядки для подальшого регулярного використання.
Підсумок
Коротше кажучи, знання про те, як працюють свинцево-кислотні акумулятори, є фундаментальним для максимізації їхньої продуктивності та довговічності. Ключовим фактором, що впливає на його загальну функціональність, є безліч хімічних реакцій, що відбуваються на обох полюсах у поєднанні з потоком іонів через електролітичний розчин під час циклів заряду-розряду.