Einführung
Blei-Säure-Batterien gehören zu den am häufigsten verwendeten Batterietypen in verschiedenen Anwendungen. Das Verständnis des Grundprinzips von Blei-Säure-Batterien ist notwendig, um sie in verschiedenen Anwendungen, z. B. in Kraftfahrzeugen oder als unterbrechungsfreie Stromquelle, sinnvoll einsetzen zu können. Eine bessere Vertrautheit mit diesen Konzepten kann die Fähigkeit verbessern, sie richtig zu pflegen und gleichzeitig ihr Potenzial für eine optimale Leistung bei Bedarf in verschiedenen Umgebungen/Kontexten zu maximieren. In diesem Artikel werden die chemischen Reaktionen im Ionenflussmechanismus untersucht, die für die Steuerung der Lade- und Entladevorgänge erforderlich sind.
Chemische Reaktion der positiven und negativen Elektroden
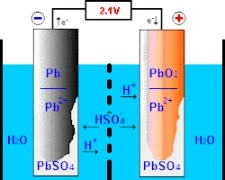
Der Betrieb von Blei-Säure-Batterien beruht auf chemischen Reaktionen an den beiden primären Elektroden – der positiven Elektrode, die aus Bleidioxid besteht, und der negativen Elektrode, die aus reinem Blei besteht. Das Verständnis für die Funktionsweise der Batterie beginnt mit ihrem Design und ihrer Konstruktion.
Bei der Einwirkung von Schwefelsäure zusammen mit einer anderen Verbindung namens „Bleidioxid“ an der positiven Elektrode führt dieses Verfahren zur Bildung von „Sauerstoffionen“ sowie einer Amalgamierung namens „Bleisulfat“. In gleichem Maße verbindet sich reines Blei mit Schwefelsäure unter Bildung von Wasserstoffionen und ergibt Bleisulfat. Als Ergebnis der zuvor beschriebenen Abfolge von Ereignissen wird chemische Energie in elektrische Energie umgewandelt, die in der modernen Gesellschaft für verschiedene Zwecke genutzt wird.
Der Fluss der Ionen in einer Elektrolytlösung
Um einen effektiven Ionenaustausch zwischen positiv und negativ markierten Elektroden zu ermöglichen, ist es wichtig, eine Elektrolytlösung einzuführen. Diese Lösung besteht häufig aus Wasser, das mit Schwefelsäure gemischt ist, die als Träger für diese Ionen dient. Diese wichtige Verbindung kann die ordnungsgemäße Funktion der Batterie durch ihre Sulfationen (SO₄²-) unterstützen, die bei jeder Ladung und Entladung aktiv wandern.
Während des Ladevorgangs erleichtert elektrischer Strom die Bewegung von geladenen Schwefelverbindungen, die in Elektrolyten in einer typischen Batterie gelöst sind, über positiv geladene Spuren, die durch elektrolytische Wirkung in negativ geladene Bereiche oder Spuren übergehen. Diese Umwandlungsaktivität kehrt die Konversionsbildung um, die die frühere Speicherung behindert hat, indem sie durch den Lade-Entlade-Zyklus einen festen in einen flüssigen Zustand umwandelt. Durch die allmähliche Erneuerung können diese Batterien so weit entwickelt werden, dass sie elektrische Ladungen mit unterschiedlichen Speicherkapazitäten für verschiedene Anwendungen sicher speichern können.
Schematische Darstellung und Beschreibung des Lade- und Entladevorgangs
Die genaue Funktionsweise von wiederaufladbaren Batterien, wie z. B. Blei-Säure-Batterien, zu verstehen, mag kompliziert erscheinen, ist aber einfacher zu handhaben, wenn man sie mit Hilfe von schematischen Beschreibungen visualisiert. Wir stellen fest, dass zum Aufladen eine externe Stromversorgung erforderlich ist, damit eine interne chemische Reaktion stattfinden kann, bei der sich inaktive Bereiche wie Bleisulfat wieder in aktive Chemikalien wie reines Blei oder Bleidioxid umwandeln, was eine erneute Energiespeicherung in den Zellen unserer wiederaufladbaren Batterien ermöglicht.
Bei der Entladung elektrischer Energie in einen externen Stromkreis durchläuft eine Batterie eine chemische Umwandlung: Ihre Schwefelsäure reagiert mit reinem Blei und Bleidioxid zu großen Mengen von Bleisulfat. Dieser Prozess verbraucht kontinuierlich die gespeicherte Energie des Geräts, bis seine Spannung vollständig abfällt, so dass es für die weitere Nutzung regelmäßig wieder aufgeladen werden muss.
Die Quintessenz
Kurz gesagt, das Wissen über die Funktionsweise von Blei-Säure-Batterien ist grundlegend für die Maximierung ihrer Produktivität und Langlebigkeit. Der Schlüsselfaktor, der zu seiner Gesamtfunktionalität beiträgt, ist die Vielzahl chemischer Reaktionen, die an beiden Polen in Verbindung mit dem Ionenfluss in der Elektrolytlösung während der Lade-/Entladezyklen stattfinden.