Introdução
As baterias de chumbo-ácido são um dos tipos mais comuns de baterias utilizadas em várias aplicações. Compreender o princípio básico das baterias de chumbo-ácido é necessário para as utilizar corretamente em várias aplicações, tais como automóveis ou fontes de energia ininterrupta. Uma maior familiaridade com estes conceitos pode melhorar a capacidade de os manter corretamente, maximizando o seu potencial para um desempenho ótimo a pedido em diferentes cenários/contextos. Este artigo explora as reacções químicas no mecanismo de fluxo de iões necessárias para controlar os processos de carga e descarga.
Reação química dos eléctrodos positivo e negativo
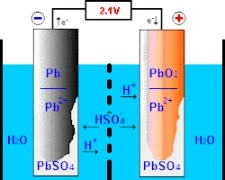
O funcionamento das baterias de chumbo-ácido implica reacções químicas nos seus dois eléctrodos primários – o elétrodo positivo, composto por dióxido de chumbo, e o elétrodo negativo, chumbo puro. A compreensão do funcionamento da bateria começa com a sua conceção e construção.
Quando exposto ao ácido sulfúrico juntamente com outro composto chamado “dióxido de chumbo” no elétrodo positivo, este procedimento resulta na produção de “iões de oxigénio”, bem como numa amálgama chamada “sulfato de chumbo”. A um ritmo igual, o chumbo puro combina-se com o ácido sulfúrico para formar iões de hidrogénio e produzir sulfato de chumbo. Como resultado da série de eventos descrita anteriormente, a energia química é convertida em energia eléctrica, que é utilizada para vários fins na sociedade moderna.
O fluxo de iões numa solução electrolítica
É fundamental introduzir uma solução electrolítica para permitir uma troca iónica eficaz entre os eléctrodos marcados positiva e negativamente. Esta solução é frequentemente composta por água misturada com ácido sulfúrico que actua como transportador destes iões. Este composto crítico pode suportar o funcionamento adequado da bateria através dos seus iões de sulfato (SO₄²-), que migram ativamente ao longo de cada carga e descarga.
Durante o modo de carregamento, a corrente eléctrica facilita o movimento de compostos de enxofre carregados que estão dissolvidos em electrólitos numa bateria típica através de traços carregados positivamente, fazendo a transição para regiões ou traços carregados negativamente através de ação electrolítica. Esta atividade transformacional inverte a formação de conversão que impedia o armazenamento anterior, transformando os estados sólidos em fluidos através do ciclo Carga-Descarga. O restauro gradual permite, portanto, que estas baterias se tornem suficientemente capazes de armazenar cargas eléctricas de forma segura com diversas capacidades de armazenamento em várias aplicações.
Esquema e descrição do processo de carga e descarga
Compreender exatamente como as baterias recarregáveis, como as que utilizam o design de chumbo-ácido, recarregam, pode parecer complicado, mas pode ser mais fácil de gerir quando visualizado utilizando descrições de esquemas. Essencialmente, observamos que o carregamento requer a alimentação de energia a partir de uma fonte eléctrica externa, de modo a que possa ocorrer uma reação química interna em que as regiões inactivas, como o sulfato de chumbo, se transformem novamente em substâncias químicas activas, como o chumbo puro ou o dióxido de chumbo – permitindo o armazenamento de energia renovada nas células das nossas pilhas recarregáveis.
Ao descarregar energia eléctrica num circuito externo, uma pilha sofre uma transformação química: o seu ácido sulfúrico reage com o chumbo puro e o dióxido de chumbo para produzir grandes quantidades de sulfato de chumbo. Este processo consome constantemente a energia armazenada do dispositivo até que a sua tensão diminua completamente, exigindo um recarregamento imediato para uma utilização regular.
A linha de fundo
Em resumo, o conhecimento sobre o funcionamento das baterias de chumbo-ácido é fundamental para maximizar a sua produtividade e longevidade. O principal fator que contribui para a sua funcionalidade global é a multiplicidade de reacções químicas que ocorrem em ambos os pólos em conjunto com o fluxo de iões através da sua solução electrolítica durante os ciclos de carga-descarga.