Introduction
Les batteries plomb-acide sont l’un des types de batteries les plus courants utilisés dans diverses applications. Il est nécessaire de comprendre le principe de base des batteries plomb-acide pour pouvoir les utiliser à bon escient dans diverses applications, telles que l’automobile ou les sources d’énergie sans interruption. Une meilleure connaissance de ces concepts peut améliorer la capacité d’une personne à les entretenir correctement tout en maximisant leur potentiel pour une performance optimale à la demande dans différents environnements/contextes. Cet article explore les réactions chimiques dans le mécanisme de flux d’ions nécessaire pour contrôler les processus de charge et de décharge.
Réaction chimique des électrodes positives et négatives
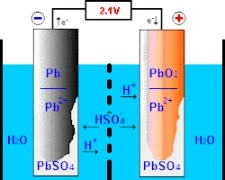
Le fonctionnement des batteries plomb-acide implique des réactions chimiques au niveau de ses deux électrodes primaires – l’électrode positive, composée de dioxyde de plomb, et l’électrode négative, constituée de plomb pur. La compréhension du fonctionnement de la batterie commence par sa conception et sa construction.
Lorsqu’il est exposé à l’acide sulfurique et à un autre composé appelé « dioxyde de plomb » à l’électrode positive, ce procédé entraîne la production d' »ions oxygène » et d’un amalgame appelé « sulfate de plomb ». À un rythme égal, le plomb pur se combine à l’acide sulfurique pour former des ions hydrogène et produire du sulfate de plomb. À la suite de la série d’événements décrits précédemment, l’énergie chimique est convertie en énergie électrique, qui est utilisée à diverses fins dans la société moderne.
Le flux d’ions dans une solution électrolytique
Il est fondamental d’introduire une solution électrolytique pour permettre un échange d’ions efficace entre les électrodes marquées positivement et négativement. Cette solution comprend souvent de l’eau mélangée à de l’acide sulfurique qui sert de support à ces ions. Ce composé essentiel peut contribuer au bon fonctionnement de la batterie grâce à ses ions sulfate (SO₄²-), qui migrent activement au cours de chaque charge et décharge.
En mode de charge, le courant électrique facilite les mouvements des composés sulfurés chargés qui sont dissous dans les électrolytes à l’intérieur d’une batterie typique à travers les traces chargées positivement, passant à des régions ou des traces chargées négativement en utilisant l’action électrolytique. Cette activité de transformation inverse la formation de conversion qui entravait le stockage précédent en transformant les états solides en états fluides par le biais du cycle charge-décharge. La restauration progressive permet donc à ces batteries de devenir suffisamment performantes pour stocker en toute sécurité des charges électriques avec diverses capacités de stockage dans différentes applications.
Schéma et description du processus de charge et de décharge
Comprendre précisément comment se rechargent les batteries rechargeables, comme celles qui utilisent le concept de l’acide-plomb, peut sembler compliqué mais peut être plus facile à gérer lorsque l’on visualise les descriptions des schémas. En substance, nous observons que la charge nécessite une alimentation électrique externe pour qu’une réaction chimique interne puisse avoir lieu, dans laquelle les régions inactives comme le sulfate de plomb se réorganisent en produits chimiques actifs, comme le plomb pur ou le dioxyde de plomb, ce qui permet de renouveler le stockage d’énergie dans les cellules de nos batteries rechargeables.
Lorsqu’elle décharge de l’énergie électrique dans un circuit externe, une batterie subit une transformation chimique : son acide sulfurique réagit avec le plomb pur et le dioxyde de plomb pour produire de grandes quantités de sulfate de plomb. Ce processus consomme régulièrement l’énergie stockée dans l’appareil jusqu’à ce que sa tension diminue complètement, ce qui nécessite une recharge immédiate pour une utilisation régulière.
La ligne de fond
En bref, il est essentiel de connaître le fonctionnement des batteries au plomb pour maximiser leur productivité et leur longévité. Le facteur clé contribuant à sa fonctionnalité globale est la multitude de réactions chimiques se produisant aux deux pôles en conjonction avec le flux d’ions dans sa solution électrolytique au cours des cycles de charge-décharge.