Introducción
Las baterías de plomo-ácido son uno de los tipos más comunes de baterías utilizadas en diversas aplicaciones. Comprender el principio básico de las baterías de plomo-ácido es necesario para hacer un buen uso de ellas en diversas aplicaciones, como la automoción o las fuentes de alimentación ininterrumpida. Familiarizarse con estos conceptos puede mejorar la capacidad de mantenerlos adecuadamente y maximizar su potencial de rendimiento óptimo a demanda en diferentes entornos/contextos. Este artículo explora las reacciones químicas en el mecanismo de flujo de iones necesarias para controlar los procesos de carga y descarga.
Reacción química de los electrodos positivo y negativo
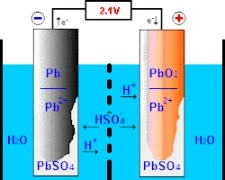
El funcionamiento de las baterías de plomo-ácido implica reacciones químicas en sus dos electrodos primarios: el positivo, compuesto de dióxido de plomo, y el negativo, de plomo puro. Entender el funcionamiento de la pila empieza por su diseño y construcción.
Cuando se expone al ácido sulfúrico junto con otro compuesto llamado «dióxido de plomo» en el electrodo positivo, este procedimiento da lugar a la producción de «iones de oxígeno», así como a una amalgama llamada «sulfato de plomo». A igual ritmo, el plomo puro se combina con el ácido sulfúrico para formar iones de hidrógeno y da sulfato de plomo. Como resultado de la serie de acontecimientos descritos anteriormente, la energía química se convierte en energía eléctrica, que se utiliza para diversos fines en la sociedad moderna.
El flujo de iones en una solución electrolítica
Es fundamental introducir una solución electrolítica para permitir un intercambio eficaz de iones entre los electrodos marcados positiva y negativamente. Esta solución suele estar compuesta por agua mezclada con ácido sulfúrico que actúa como portador de estos iones. Este compuesto crítico puede contribuir al correcto funcionamiento de la batería a través de sus iones de sulfato (SO₄²-), que migran activamente a lo largo de cada carga y descarga.
Mientras está en modo de carga, la corriente eléctrica facilita los movimientos de los compuestos de azufre cargados que están disueltos en electrolitos dentro de una batería típica a través de trazas cargadas positivamente, pasando hacia regiones o trazas cargadas negativamente utilizando la acción electrolítica. Esta actividad de transformación invierte la formación de la conversión que obstaculizaba el almacenamiento anterior, transformando los estados sólido a fluido mediante el ciclo de carga-descarga. Por lo tanto, la restauración gradual permite que estas baterías sean lo suficientemente capaces para almacenar cargas eléctricas de forma segura con diversas capacidades de almacenamiento en varias aplicaciones.
Esquema y descripción del proceso de carga y descarga
Comprender con precisión cómo se recargan las pilas recargables, como las que utilizan el diseño de plomo-ácido, puede parecer complicado, pero puede ser más manejable si se visualiza mediante descripciones esquemáticas. En esencia, observamos que la carga requiere la alimentación de una fuente eléctrica externa para que pueda producirse una reacción química interna en la que las regiones inactivas, como el sulfato de plomo, se transformen de nuevo en sustancias químicas activas, como el plomo puro o el dióxido de plomo, lo que permite renovar el almacenamiento de energía en las celdas de nuestras baterías recargables.
Al descargar energía eléctrica en un circuito externo, una batería sufre una transformación química: su ácido sulfúrico reacciona con el plomo puro y el dióxido de plomo para producir grandes cantidades de sulfato de plomo. Este proceso consume de forma constante la energía almacenada del dispositivo hasta que su voltaje disminuye por completo, lo que requiere una recarga inmediata para seguir utilizándolo con regularidad.
Lo esencial
En resumen, conocer cómo funcionan las baterías de plomo-ácido es fundamental para maximizar su productividad y longevidad. El factor clave que contribuye a su funcionalidad global es la multitud de reacciones químicas que se producen en ambos polos junto con el flujo de iones a través de su solución electrolítica durante los ciclos de carga y descarga.