Введение
Свинцово-кислотные аккумуляторы являются одним из наиболее распространенных типов аккумуляторов, используемых в различных приложениях. Понимание основного принципа работы свинцово-кислотных аккумуляторов необходимо для правильного использования их в различных приложениях, например, в автомобильной промышленности или в источниках бесперебойного питания. Более глубокое знакомство с этими понятиями может повысить способность поддерживать их в надлежащем состоянии, максимально увеличивая их потенциал для оптимальной работы по требованию в различных условиях/контекстах. В статье рассматриваются химические реакции в механизме ионного потока, необходимые для управления процессами зарядки и разрядки.
Химическая реакция положительного и отрицательного электродов
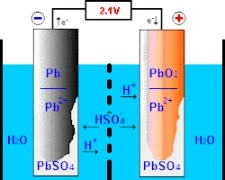
В процессе работы свинцово-кислотного аккумулятора происходят химические реакции на двух его первичных электродах — положительном, состоящем из диоксида свинца, и отрицательном, представляющем собой чистый свинец. Понимание работы аккумулятора начинается с его конструкции и устройства.
При воздействии серной кислоты на положительный электрод вместе с другим соединением, называемым «диоксидом свинца», в результате образуются «ионы кислорода», а также амальгама, называемая «сульфатом свинца». В равном темпе чистый свинец соединяется с серной кислотой с образованием ионов водорода и дает сульфат свинца. В результате описанной ранее последовательности событий химическая энергия преобразуется в электрическую, которая используется для различных целей в современном обществе.
Поток ионов в растворе электролита
Принципиальным является введение раствора электролита для обеспечения эффективного ионного обмена между положительно и отрицательно маркированными электродами. В качестве носителя этих ионов часто используется вода, смешанная с серной кислотой. Это важнейшее соединение поддерживает нормальную работу аккумулятора благодаря сульфат-ионам (SO₄²-), которые активно мигрируют в процессе заряда и разряда.
В режиме зарядки электрический ток способствует перемещению заряженных сернистых соединений, растворенных в электролитах типового аккумулятора, по положительно заряженным дорожкам, переходящим в отрицательно заряженные участки или дорожки за счет электролитического воздействия. Эта трансформационная активность позволяет обратить вспять процесс образования конверсии, препятствовавший предыдущему хранению, путем преобразования твердого состояния в жидкое в рамках цикла «заряд-разряд». Таким образом, постепенное восстановление аккумуляторов позволяет им стать достаточно мощными для надежного хранения электрического заряда с различными возможностями хранения в различных областях применения.
Схема и описание процесса заряда и разряда
Понимание того, как именно заряжаются аккумуляторные батареи, например, свинцово-кислотные, может показаться сложным, но может быть более понятным при визуализации с помощью описания схем. По сути, мы видим, что для зарядки необходимо подать питание от внешнего источника, чтобы произошла внутренняя химическая реакция, в результате которой неактивные участки, такие как сульфат свинца, снова превращаются в активные химические вещества, такие как чистый свинец или диоксид свинца, что позволяет вновь накапливать энергию в элементах наших аккумуляторных батарей.
Отдавая электрическую энергию во внешнюю цепь, аккумулятор претерпевает химическое превращение: серная кислота вступает в реакцию с чистым свинцом и диоксидом свинца, образуя большое количество сульфата свинца. Этот процесс неуклонно расходует запас энергии устройства до полного снижения напряжения, что требует немедленной подзарядки для дальнейшего регулярного использования.
Итоги
Вкратце, знание принципов работы свинцово-кислотных аккумуляторов является основополагающим для обеспечения их максимальной производительности и долговечности. Ключевым фактором, определяющим его общую функциональность, является множество химических реакций, протекающих на обоих полюсах в сочетании с ионным потоком в электролитическом растворе во время циклов заряда-разряда.